Vacuna contra la gripe pandémica H1N1: ¿porqué no se informó al público de los signos precoces de alerta?
Ocho años después del brote de influenza pandémica, una demanda que alega que la vacuna Pandemrix de GlaxoSmithKline causó narcolepsia ha desenterrado informes internos que sugieren problemas con la seguridad de la vacuna. Peter Doshi pregunta qué significa esto para el futuro de la transparencia durante las emergencias de salud pública.
Fuente: BMJ 2018 ; 362 doi: https://doi.org/10.1136/bmj.k3948 (publicado el 20 de septiembre de 2018)C ite esto como: BMJ 2018; 362: k3948. Peter Doshi, editor asociado, El BMJ
En octubre de 2009, el jefe de enfermedades infecciosas de los Institutos Nacionales de la Salud de los Estados Unidos, Anthony Fauci, apareció en YouTube para tranquilizar a los estadounidenses sobre la seguridad de la vacuna contra la «gripe porcina». “El historial de eventos adversos graves es muy bueno. Es muy, muy, muy raro que se llegue a ver algo asociado con la vacuna que sea un evento serio,” 1 , dijo.
Cuatro meses antes, la Organización Mundial de la Salud había declarado que la influenza H1N1 era una pandemia y, en octubre de 2009, las nuevas vacunas se estaban implementando en todo el mundo. Una historia similar se estaba desarrollando en el Reino Unido, con organizaciones prominentes, como el Departamento de Salud, la Asociación Médica Británica y los Reales Colegios de Médicos Generales, trabajando arduamente para convencer a una fuerza laboral del NHS reacia a que se vacunara. 2 «Apoyamos plenamente el programa de vacunación contra la gripe porcina … La vacuna se ha probado exhaustivamente», declararon en una declaración conjunta. 3
Excepto que no lo habían hecho. Anticipándose a una pandemia de influenza grave, los gobiernos de todo el mundo hicieron varios arreglos logísticos y legales para acortar el tiempo entre el reconocimiento de un virus pandémico y la producción de una vacuna y la administración de esa vacuna a la población. En Europa, uno de los elementos de esos planes fue un acuerdo para otorgar licencias para vacunas pandémicas basadas en datos de vacunas de «simulación» pre pandémicas producidas con un virus diferente (influenza H5N1). Otro elemento, adoptado por países como Canadá, EE. UU., Reino Unido, Francia y Alemania, fue proporcionar a los fabricantes de vacunas una indemnización de responsabilidad por irregularidades, reduciendo así el riesgo de una demanda derivada de lesiones relacionadas con la vacuna. 4 5
En una entrevista con The BMJ , Liam Donaldson, director médico de Inglaterra en ese momento, recordó la situación del lanzamiento de octubre de 2009: «El Reino Unido trabajó durante varios años en sus planes de influenza pandémica, como parte de un enfoque coordinado a nivel mundial. Esto incluyó, con mucha antelación, establecer el proceso para desarrollar e introducir una vacuna en una emergencia de salud pública.
“Frente a una pandemia emergente de gravedad desconocida, se inició el proceso. El comité científico nacional de vacunas (JCVI) y las autoridades reglamentarias
de los medicamentos participaron plenamente en los pasos del procedimiento que llevaron a la introducción y el uso de la vacuna. «Esta no fue una decisión de política tomada en ausencia de tal experiencia», dijo.
Controversia
Las vacunas contra la influenza son posiblemente las únicas vacunas que una parte notable de los profesionales de la salud rechazan a pesar de las recomendaciones. 6 Y a fines de 2009, las vacunas contra la gripe porcina H1N1, que resultó ser una pandemia mucho más leve de lo que los funcionarios habían pronosticado, fueron incluso más controvertidas de lo normal.
En Alemania, los médicos veteranos expresaron dudas sobre la vacuna Pandemrix de GlaxoSmithKline. Estaban preocupados por los posibles efectos secundarios provocados por el adyuvante AS03, una emulsión de aceite en agua que contenía para aumentar la eficacia. 7 Luego surgió una controversia cuando el periódico alemán Der Spiegel informó que los principales políticos y empleados del gobierno iban a recibir Celvapan, la vacuna contra el virus de la gripe H1N1 no adyuvada de Baxter, no Pandemrix. 7
Las preocupaciones, al parecer, eran proféticas. Un año más tarde, las señales de un problema con Pandemrix emergían a través de informes posteriores a la comercialización de narcolepsia, principalmente entre niños y adolescentes en Suecia y Finlandia. 8 Múltiples estudios académicos y dirigidos por el gobierno posteriormente juzgaron que la relación entre Pandemrix y la narcolepsia probablemente sea causal. 9 10 11 Se estima que más de 1300 personas se han visto afectadas entre los aproximadamente 30 millones de vacunados en toda Europa, 12incluyendo alrededor de 100 familias en el Reino Unido. 13
Sin embargo, GSK y la Agencia Europea de Medicamentos, que ha autorizado Pandemrix, no han aceptado que la asociación con narcolepsia haya demostrado ser causal, y la investigación sobre el tema continúa. 14 GSK dijo a The BMJ que «se necesitan más investigaciones para confirmar el papel que Pandemrix pudo haber tenido en el desarrollo de la narcolepsia entre los afectados».
Siguieron reclamaciones de indemnización, muchos de las cuales aún están luchando en los tribunales. 15
Ahora, ocho años después del brote, surge una nueva información de una de las demandas que: meses antes de que se denunciaran los casos de narcolepsia, el fabricante y los funcionarios de salud pública conocían otros eventos adversos graves registrados en relación con Pandemrix.
Problema no revelado
En los documentos obtenidos a través del proceso de descubrimiento previo al juicio (ver datos complementarios en bmj.com), los fiscales que demandan al Ministro de Salud de Irlanda, al Ejecutivo del Servicio de Salud, a la Autoridad Reguladora de Productos de Salud y GSK han encontrado una serie de informes de seguridad posteriores a la comercialización de GSK que muestran una notable diferencia en el número y la frecuencia de los eventos adversos informados para tres vacunas pandémicas GSK aprobadas y utilizadas en todo el mundo: Pandemrix, Arepanrix, una vacuna similar contra el H1N1 que también contenía adyuvante AS03 y una vacuna contra el H1N1 sin adyuvante (no se proporciona una marca).
El BMJ se enteró de los informes de mi colega Tom Jefferson, un epidemiólogo con capacitación médica que fue contratado como testigo experto por los abogados que representan a Aoife Bennett, una mujer irlandesa que desarrolló narcolepsia después de la vacunación con Pandemrix en 2009. Jefferson asumió el caso en 2015 y el año pasado, los abogados recibieron una copia de los informes de seguridad de GSK que se habían enviado por correo electrónico dentro de la empresa y al menos a un regulador (Irlanda). Las tablas de eventos adversos incluidas en nueve informes que abarcan los cuatro meses comprendidos entre diciembre de 2009 y marzo de 2010 ofrecen un vistazo a los perfiles de seguridad de las vacunas.
“Cuando vi esas mesas, me caí de la silla. Un consumidor puede averiguar qué está pasando aquí”, me dijo Jefferson (tabla 1).
tabla 1
Reproducción de la tabla de informes de eventos adversos del informe interno de GSK del 2 de diciembre de 2009 *
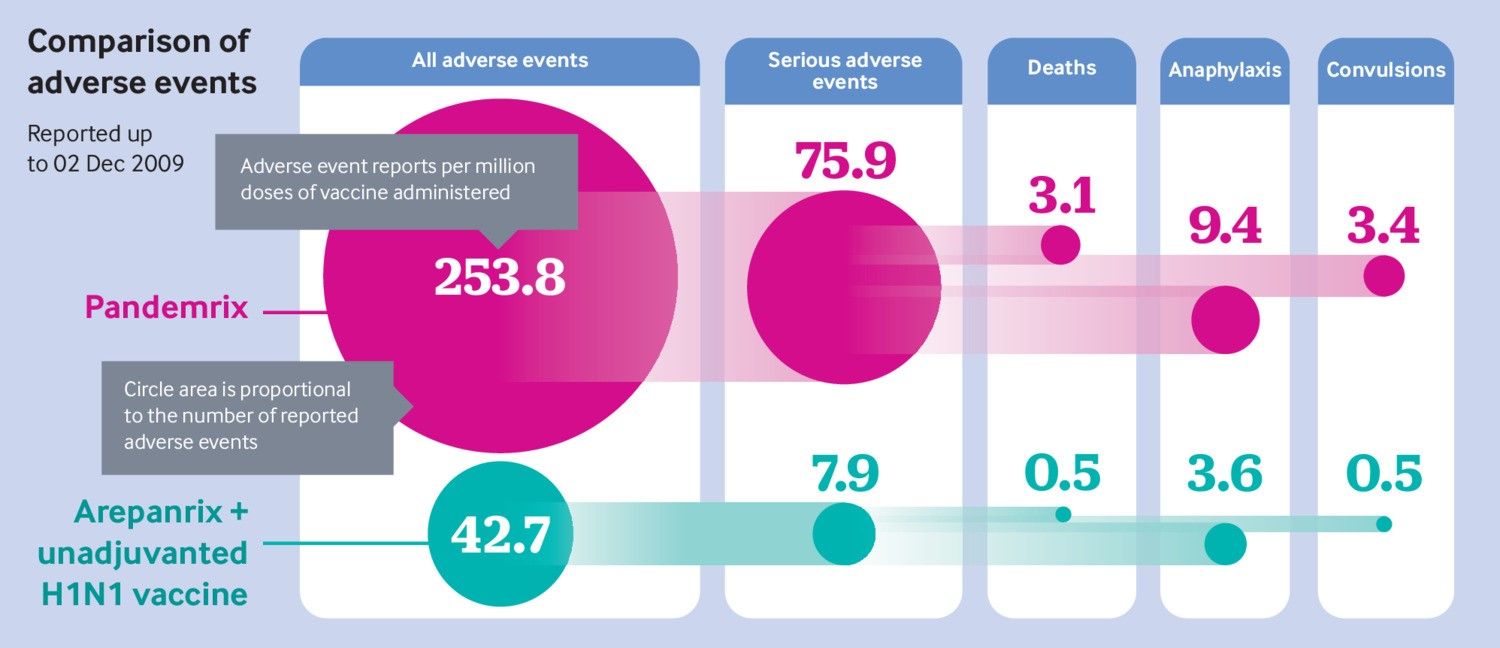
Jefferson calculó de inmediato las tasas de eventos adversos para cada vacuna, que mostraron grandes diferencias entre Pandemrix y Arepanrix. Cualquier diferencia real entre las vacunas sería especialmente alarmante porque Pandemrix y Arepanrix son, en términos generales, la misma vacuna fabricada en diferentes instalaciones y utilizada en diferentes países. Las tasas divergentes de eventos adversos pueden implicar un problema de fabricación.
“Las razones de probabilidades, las estimaciones puntuales, son todas altas. Y algunos de ellos son significativamente altos: 5,39 [intervalo de confianza del 95%: 3,70 a 7,85] para las muertes [para Pandemrix v las otras vacunas]”, dijo Jefferson.
«Lo que me llamó la atención no fue solo que los ratios odds eran altos, sino el hecho de que nadie los había tabulado y analizado», dijo, señalando que los informes GSK proporcionaban datos de numeradores y denominadores suficientes para calcular los ratios odds, pero en realidad no contienen esos cálculos.
El BMJ realizó su propio análisis de los eventos adversos, la mayoría de los cuales parecen haber sido reportados espontáneamente a GSK ( figuras 1 y 2 ). Para un rango de eventos adversos preocupantes, los informes para Pandemrix fueron consistentemente más altos que para las otras dos vacunas pandémicas GSK: cuatro veces la tasa de parálisis facial, ocho veces la tasa de eventos adversos graves, nueve veces la tasa de eventos adversos graves. convulsiones. En general, Pandemrix tuvo, proporcionalmente, cinco veces más eventos adversos informados que Arepanrix y la vacuna no adyuvada.
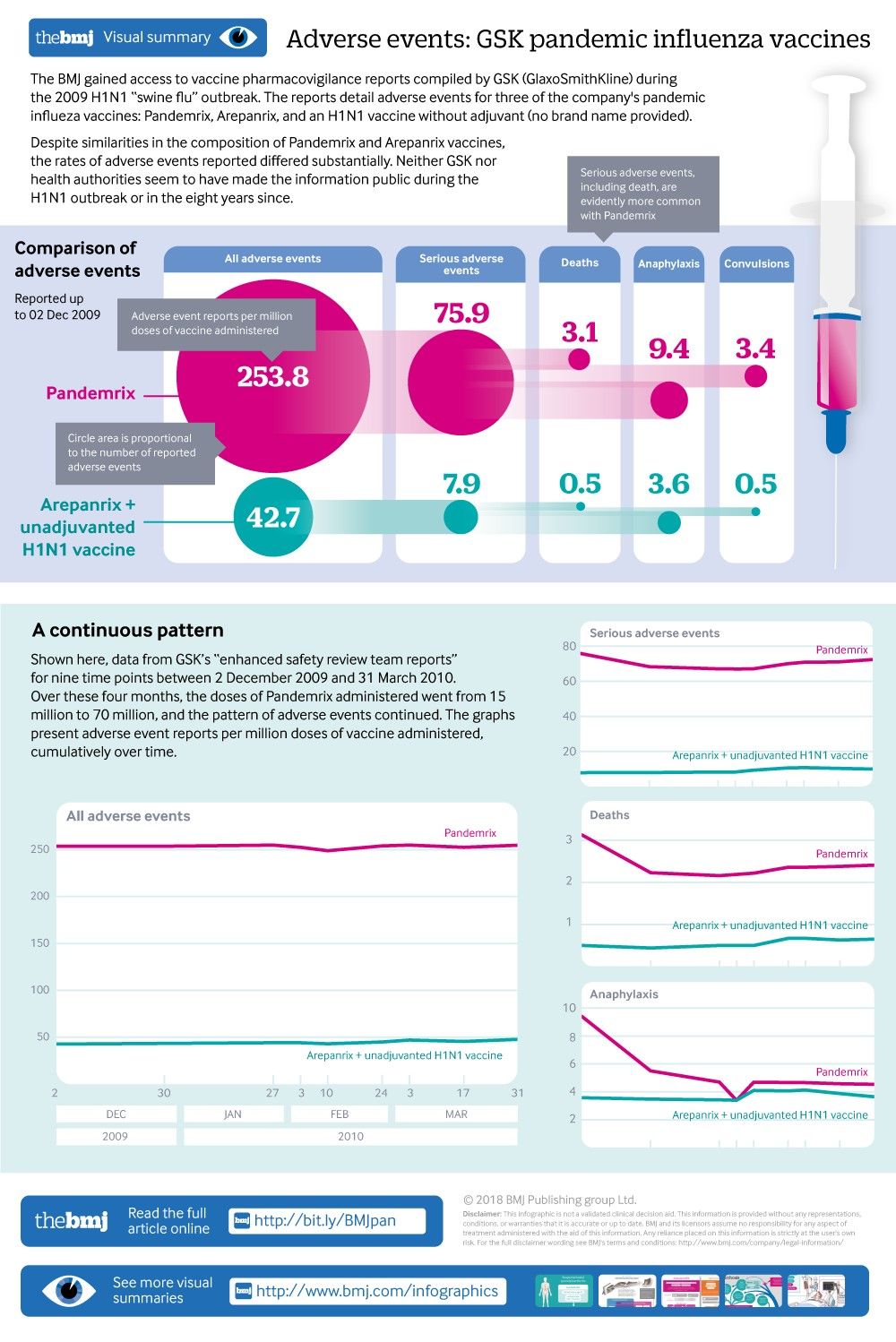 Informes de eventos adversos (número / millón de dosis) para vacunas contra la influenza pandémica GSK hasta el 2 de diciembre de 2009 (GSK informa el número de dosis para Arepanrix y la vacuna no adyuvante juntas)
Informes de eventos adversos (número / millón de dosis) para vacunas contra la influenza pandémica GSK hasta el 2 de diciembre de 2009 (GSK informa el número de dosis para Arepanrix y la vacuna no adyuvante juntas)
Tasa acumulada de eventos adversos (número / millón de dosis) para vacunas contra la influenza pandémica a lo largo del tiempo, diciembre de 2009 a marzo de 2010
Y el número bruto de eventos adversos no fue pequeño. Aunque a menudo se dice que tal vez solo hasta el 10% de los eventos adversos se notifican a los sistemas de informes nacionales 16 , a finales de noviembre, GSK había recibido 1138 informes de eventos adversos graves para Pandemrix, una tasa de 76 por millón de dosis administradas. A mediados de diciembre, había 3280 informes de eventos adversos graves (68 / millón de dosis). El último informe visto por The BMJ , con fecha del 31 de marzo de 2010, muestra 5069 eventos adversos graves para Pandemrix (72 / millón de dosis), siete veces la tasa de Arepanrix y la vacuna no adyuvada combinadas.
Los datos no son suficientes para sacar conclusiones sobre la causa y el efecto, pero para Gillian O’Connor, la abogada que representa a Bennett, plantean serias dudas sobre la transparencia. La disparidad, escribió en una declaración jurada presentada ante el tribunal, fue «de tal diferencia notable que cualquier persona que esté considerando tomar la vacuna Pandemrix sería probable, si recibiera esta información, no elegir la vacuna Pandemrix».
Campanas de alarma que nunca sonaban.
Pero ni GSK ni las autoridades sanitarias parecen haber hecho pública la información, ni está claro que se investigó la disparidad. Esto contrasta con la reacción a la narcolepsia, que apareció rápidamente en los titulares de las noticias y fue objeto de un comunicado de prensa e investigación de GSK 17 en cuestión de semanas después de los primeros informes de Suecia y Finlandia.
 En muchos de los informes de GSK, la compañía menciona brevemente haber realizado «revisiones de seguridad», por ejemplo, con respecto a la anafilaxia, la parálisis facial y el síndrome de Guillain-Barré. El BMJ solicitó a GSK una copia de esas revisiones, pero no las proporcionó.
En muchos de los informes de GSK, la compañía menciona brevemente haber realizado «revisiones de seguridad», por ejemplo, con respecto a la anafilaxia, la parálisis facial y el síndrome de Guillain-Barré. El BMJ solicitó a GSK una copia de esas revisiones, pero no las proporcionó.
En una declaración, GSK escribió: “Después de la introducción de Pandemrix, GSK evaluó continuamente todos los datos de seguridad disponibles y compartió los datos con la EMA y otras autoridades reguladoras en las que se autorizó la vacuna para que las autoridades pudieran realizar sus propias evaluaciones independientes. EMA hizo públicos los resúmenes semanales de los datos proporcionados por GSK y otros fabricantes, y siguen siendo accesibles a través del sitio web de la EMA ”.
El BMJ preguntó a GSK si alguna vez realizó alguna investigación para comprender la discrepancia en los informes de eventos adversos entre Pandemrix y Arepanrix, si notificó a los proveedores de atención médica acerca de las discrepancias, si consideró sacar a Pandemrix del mercado o si consideró recomendar la vacuna de Arepanrix u otra compañía. Pero GSK se negó a responder a estas y todas las preguntas de The BMJ , citando litigios en curso.
El BMJ le preguntó al Departamento de Salud del Reino Unido por qué recomendó Pandemrix sobre el Celvapan de Baxter, pero el departamento también se negó a hacer comentarios, calificando la pregunta como «bastante técnica» y sugiriendo que enviemos una solicitud de libertad de información para una respuesta.
En diciembre de 2009, los manifestantes en Escocia tomaron las calles para desafiar la campaña de vacunación contra la gripe porcina del gobierno argumentando que estaba fuera de sintonía con la pandemia leve. 18
“Catástrofe evitable”
El programa de vacunación también continuó en Irlanda. «El gobierno irlandés siguió invitando a las personas a vacunarse», observó Jefferson. «Esto fue cuando quedó bastante claro que la pandemia estaba en decadencia y no se acercaba a la catástrofe representada por los investigadores de la influenza, los gobiernos, la industria y los medios».
Clare Daly, miembro del parlamento irlandés, calificó los eventos adversos después de Pandemrix como una «catástrofe completamente evitable» y ha estado demandando respuestas durante más de un año. 19 En la Asamblea Nacional de Irlanda el año pasado, ella le dijo a la entonces primera ministra, Enda Kenny, «El Ejecutivo del Servicio de Salud (HSE) decidió comprar Pandemrix y continuó distribuyéndolo incluso después de saber que era peligroso y no había sido probado, y antes de la mayoría de los el público en Irlanda lo recibió”. 20 En respuesta, Taoiseach dijo que las preocupaciones sobre la seguridad de Pandemrix y las acciones de GSK merecen un “análisis inmediato”. El BMJ solicitó información actualizada sobre la investigación al Departamento de Salud de Irlanda, pero no recibió Una respuesta directa.
Lo que EMA sabía, o podría haber sabido, sobre la seguridad comparativa de las vacunas pandémicas de GSK es difícil de discernir. Le dijo a The BMJ que «EMA no realiza evaluaciones comparativas de beneficios y riesgos entre productos aprobados en la UE, o entre productos de la UE y productos aprobados o utilizados fuera de la UE».
Pero, si lo hubiera querido, ¿tenía la agencia los datos para realizar ese análisis? A pesar de la similitud entre las dos vacunas, Arepanrix no fue autorizada en la UE hasta marzo de 2010, al final de la pandemia, y los requisitos de informe de datos para las dos vacunas fueron diferentes.
«Si bien podría haber sido posible estimar las tasas de notificación basadas en los datos de uso, que son difíciles de obtener durante una pandemia, la EMA no tiene una metodología para comparar las tasas de notificación entre dos productos (tenga en cuenta que las actualizaciones de farmacovigilancia de influenza pandémica incluyeron la cantidad de informes), no tarifas)”, dijo un portavoz de la EMA.
Jefferson fue invencible. “¿Cuál es el propósito de la farmacovigilancia si nadie actúa sobre la información? Esta información tardó ocho años en salir a la luz a través del trabajo académico y el litigio. ¿Es esto aceptable? «Si la información a nuestra disposición es parcial, es consecuencia directa del secreto, que no debe rodear ninguna intervención de salud pública».
Pandemrix y Arepanrix fueron diseñados para una pandemia y fueron eliminados de los mercados globales después de la pandemia.
Independientemente de los eventos adversos que puedan haber causado, son vacunas del pasado. Pero los eventos de 2009-10 plantean cuestiones fundamentales sobre la transparencia de la información. ¿Cuándo tienen los funcionarios de salud pública el deber de advertir al público sobre los posibles daños de las vacunas detectadas a través de la farmacovigilancia?
¿Cuántos detalles debe proporcionarse al público, quién debe proporcionarlos y si la provisión de dicha información debe ser proactiva o pasiva?
Si la historia se repitiera, ¿tiene el público el derecho a saber?
Referencias
- Departamento de Salud y Servicios Humanos de los Estados Unidos. ¿Qué tan segura es la vacuna contra la gripe?26 de octubre de 2009. https://www.youtube.com/watch?v=TE4cNqcBCEQ
- Se lanzó el programa de vacunación masiva contra la gripe porcina O. Bowcott. Guardian 2009 21 de octubre.Http://www.theguardian.com/world/2009/oct/21/swine-flu-mass-vaccination
- Asociación Médica Británica, Colegio Real de Médicos Generales, Colegio Real de Matronas, et al. Vacunación contra la gripe porcina.https://www.rcm.org.uk/sites/default/files/Swine%20Flu%20Vaccination%20-%20joint%20statement%20FINAL.pdf
- Porter T. Las víctimas de la vacuna contra la gripe porcina dañadas por el cerebro en el Reino Unido obtuvieron una compensación de £ 60 millones.International Business Times 2014 Mar 2. https://www.ibtimes.co.uk/brain-damaged-uk-victims-swine-flu-vaccine-get-60-million-compensation-1438572
- Attaran A ,Wilson K
- La vacuna contra el ébola, las lesiones iatrogénicas y la responsabilidad legal. PLoS Med 2015 ; 12 :e1001911 . doi: 10.1371 / journal.pmed.1001911 pmid: 26625163
- Centros para el Control y Prevención de Enfermedades (CDC)
- Cobertura de vacunación contra la influenza entre el personal de atención médica: Estados Unidos, temporada de influenza 2010-11 . MMWR Morb Mortal Wkly Rep 2011 ; 60 : 1073- 7 . pmid: 21849963
- Stafford N
- Solo el 12% de los alemanes dicen que recibirán la vacuna contra el H1N1 después de que la fila explote por la seguridad de los adyuvantes. BMJ 2009 ; 339 : b4335 . doi: 10.1136 / bmj.b4335 pmid: 19846501
- Centro Europeo de Prevención y Control de Enfermedades. Narcolepsia en asociación con la vacunación contra la influenza pandémica (una investigación epidemiológica europea multinacional).https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/Vaesco%20report%20FINAL%20with%20cover.pdf
- Partinen M ,Saarenpää-Heikkilä O ,Ilveskoski yo, et al
- Aumento de la incidencia y el cuadro clínico de la narcolepsia infantil tras la campaña de vacunación contra la gripe H1N1 2009 en Finlandia. PLoS One 2012 ; 7 : e33723 . doi: 10.1371 / journal.pone.0033723 pmid: 22470463
- Nohynek H ,Jokinen J ,Partinen M ,et al
- AS03 La vacuna AH1N1 adyuvante asociada con un aumento abrupto en la incidencia de narcolepsia infantil en Finlandia. PLoS One 2012 ; 7 : e33536 . doi: 10.1371 / journal.pone.0033536 pmid:
- Miller E ,Andrews N ,Stellitano L ,et al
- Riesgo de narcolepsia en niños y jóvenes que reciben la vacuna contra la influenza A / H1N1 2009 pandémica adyuvada con AS03: análisis retrospectivo . BMJ 2013 ; 346 : f794 . doi: 10.1136 / bmj.f794 pmid:23444425
- Vogel G. ¿Por qué una vacuna contra la gripe pandémica causó narcolepsia?Ciencia 2015 1 de julio. Http://news.sciencemag.org/health/2015/07/why-pandemic-flu-shot-caused-narcolepsy
- Narcolepsia Reino Unido. Pandemrixhttps://www.narcolepsy.org.uk/resources/pandemrix-narcolepsy
- Branswell H. ¿La vacuna contra la gripe pandémica provocó un aumento en los casos de narcolepsia?STAT 2018 5 de julio. Https://www.statnews.com/2018/07/05/flu-vaccine-2009-pandemic-narcolepsy/
- Lintern S. A este personal del NHS se les dijo que la vacuna contra la gripe porcina era segura y ahora están sufriendo las consecuencias.BuzzFeed 2018 23 de febrero. Https://www.buzzfeed.com/shaunlintern/these-nhs-staff-were-told-the-swine-flu-vaccine-was-safe
- Rawlins MD
- Farmacovigilancia: ¿paraíso perdido, recuperado o pospuesto? La conferencia de William Withering de 1994 .JR Coll Physicians Lond 1995 ; 29 : 41 – 9 . pmid: 7738878
- PubMedWeb of ScienceGoogle Académico
- Informes de narcolepsia en Europa tras la vacunación con Pandemrix. 2010. https://www.gsk.com/en-gb/media/press-releases/reports-of-narcolepsy-in-europe-following-vaccination-with-pandemrix/
- Los manifestantes de Edimburgo marchan contra la vacuna contra la gripe porcina.Scotsman 2009 12 de diciembre. Https://www.scotsman.com/news/edinburgh-protesters-march-against-swine-flu-vaccine-1-472710https://www.scotsman.com/news/edinburgh-protesters-march contra la gripe porcina vacuna 1-472710
- Daly C.Preguntas de los líderes. YouTube, 4 de abril de 2017. https://www.youtube.com/watch?v=TkmbF2Zk4T8
- Dyer C
- El parlamentario irlandés solicita que los documentos clave de Pandemrix se entreguen a abogados que representan a niños con narcolepsia . BMJ 2017 ; 357 : j1959 . doi: 10.1136 / bmj.j1959 pmid: 28428181
- GRATIS texto completo deGoogle Académico